Termodynamiikka on tärkeä fysiikan haara. Voimme turvallisesti sanoa, että sen saavutukset ovat johtaneet teknologisen aikakauden syntymiseen ja suurelta osin määrittäneet ihmiskunnan historian kulun viimeisten 300 vuoden aikana. Artikkelissa käsitellään termodynamiikan ensimmäistä, toista ja kolmatta lakia ja niiden soveltamista käytännössä.
Mitä on termodynamiikka?
Ennen kuin muotoilet termodynamiikan lakeja, selvitetään, mitä tämä fysiikan osa tekee.
Sana "termodynamiikka" on kreikkalaista alkuperää ja tarkoittaa "lämmöstä johtuvaa liikettä". Tämä fysiikan haara siis tutkii kaikkia prosesseja, joiden seurauksena lämpöenergia muuttuu mekaaniseksi liikkeeksi ja päinvastoin.
Termodynamiikan peruslait muotoiltiin 1800-luvun puolivälissä. Tiede "liikkeestä ja kuumuudesta" tarkastelee koko järjestelmän käyttäytymistä kokonaisuutena tutkien sen makroskooppisten parametrien - lämpötilan, paineen ja tilavuuden - muutosta, eikä kiinnitä huomiota sen mikroskooppiseen rakenteeseen. Lisäksi ensimmäisellä niistä on olennainen rooli lakien muotoilussatermodynamiikka fysiikassa. On mielenkiintoista huomata, että ne on johdettu yksinomaan kokeellisista havainnoista.
Termodynaamisen järjestelmän käsite

Se tarkoittaa mitä tahansa atomien, molekyylien tai muiden elementtien ryhmää, jota pidetään kokonaisuutena. Kaikki kolme lakia on muotoiltu niin sanotulle termodynaamiselle järjestelmälle. Esimerkkejä ovat: maapallon ilmakehä, mikä tahansa elävä organismi, kaasuseos polttomoottorissa jne.
Kaikki termodynamiikan järjestelmät kuuluvat johonkin kolmesta tyypistä:
- Avoinna. Ne vaihtavat sekä lämpöä että ainetta ympäristön kanssa. Esimerkiksi, jos ruokaa kypsennetään kattilassa avoimella tulella, tämä on elävä esimerkki avoimesta järjestelmästä, koska kattila saa energiaa ulkoisesta ympäristöstä (tulesta), kun taas se itse säteilee energiaa lämmön muodossa, ja vesi myös haihtuu siitä (aineenvaihdunta).
- Suljettu. Tällaisissa järjestelmissä ei tapahdu aineen vaihtoa ympäristön kanssa, vaikka energian vaihtoa tapahtuu. Palatakseni edelliseen tapaukseen: jos peität kattilan kannella, saat suljetun järjestelmän.
- Eristetty. Tämä on eräänlainen termodynaaminen järjestelmä, joka ei vaihda ainetta tai energiaa ympäröivän tilan kanssa. Esimerkki olisi kuumaa teetä sisältävä termospullo.
Termodynaaminen lämpötila

Tämä käsite tarkoittaa ympäröivien kappaleiden muodostavien hiukkasten liike-energiaa, joka heijastaa nopeuttahiukkasten satunnainen liike. Mitä suurempi se on, sitä korkeampi lämpötila. Näin ollen jäähdytämme sitä vähentämällä järjestelmän kineettistä energiaa.
Tämä käsite tarkoittaa ympäröivien kappaleiden muodostavien hiukkasten kineettistä energiaa, joka heijastaa hiukkasten kaoottisen liikkeen nopeutta. Mitä suurempi se on, sitä korkeampi lämpötila. Näin ollen jäähdytämme sitä vähentämällä järjestelmän kineettistä energiaa.
Termodynaaminen lämpötila ilmaistaan SI:nä (International System of Units) Kelvineinä (britannialaisen tiedemiehen William Kelvinin kunniaksi, joka ehdotti ensimmäisenä tätä asteikkoa). Termodynamiikan ensimmäisen, toisen ja kolmannen lain ymmärtäminen on mahdotonta ilman lämpötilan määritelmää.
Yhden asteen jako Kelvin-asteikolla vastaa myös yhtä Celsius-astetta. Muunnos näiden yksiköiden välillä suoritetaan kaavan mukaan: TK =TC + 273, 15, missä TK ja TC - lämpötilat kelvineinä ja Celsius-asteina.
Kelvin-asteikon erikoisuus on, että sillä ei ole negatiivisia arvoja. Sen nolla (TC=-273, 15 oC) vastaa tilaa, jossa järjestelmän hiukkasten lämpöliike puuttuu kokonaan, ne näyttävät olevan "jäädytetty".
Energian säilyminen ja termodynamiikan 1. pääsääntö

Vuonna 1824 ranskalainen insinööri ja fyysikko Nicolas Léonard Sadi Carnot teki rohkean ehdotuksen, joka ei johtanut vain fysiikan kehitykseen, vaan siitä tuli myös merkittävä askel tekniikan parantamisessa. Hänenvoidaan muotoilla seuraavasti: "Energiaa ei voi luoda tai tuhota, se voidaan vain siirtää tilasta toiseen."
Itse asiassa Sadi Carnot'n lause postuloi energian säilymisen lain, joka muodosti perustan termodynamiikan ensimmäiselle laille: "Aina kun järjestelmä vastaanottaa energiaa ulkopuolelta, se muuntaa sen muihin muotoihin, jotka ovat termisiä ja mekaanisia."
1. lain matemaattinen kaava kirjoitetaan seuraavasti:
Q=ΔU + A, tässä Q on ympäristön järjestelmään siirtämän lämmön määrä, ΔU on tämän järjestelmän sisäisen energian muutos, A on täydellinen mekaaninen työ.
Adiabaattiset prosessit
Hyvä esimerkki niistä on ilmamassojen liikkuminen vuorenrinteitä pitkin. Tällaiset massat ovat v altavia (kilometrejä tai enemmän), ja ilma on erinomainen lämmöneriste. Huomattujen ominaisuuksien ansiosta voimme pitää adiabaattisina prosesseja, joissa ilmamassoja esiintyy lyhyessä ajassa. Kun ilma nousee vuoren rinteeseen, sen paine laskee, se laajenee, eli se suorittaa mekaanista työtä ja sen seurauksena se jäähtyy. Päinvastoin, ilmamassan alaspäin suuntautuvaan liikkeeseen liittyy paineen nousu siinä, se puristuu ja kuumenee tästä johtuen hyvin kuumaksi.
Edellisessä alaotsikossa käsitellyn termodynamiikan lain soveltaminen on helpoimmin osoitettavissa adiabaattisen prosessin esimerkillä.
Määritelmän mukaan sen seurauksena ei tapahdu energian vaihtoaympäristö, eli yllä olevassa yhtälössä Q=0. Tämä johtaa seuraavaan lausekkeeseen: ΔU=-A. Miinusmerkki tässä tarkoittaa, että järjestelmä suorittaa mekaanista työtä vähentämällä omaa sisäistä energiaansa. On syytä muistaa, että sisäinen energia on suoraan riippuvainen järjestelmän lämpötilasta.
Lämpöprosessien suunta
Tässä numerossa käsitellään termodynamiikan toista pääsääntöä. Varmasti kaikki huomasivat, että jos tuot kaksi erilämpöistä esinettä kosketuksiin, kylmä lämpenee aina ja kuuma jäähtyy. Huomaa, että käänteinen prosessi voi tapahtua termodynamiikan ensimmäisen lain puitteissa, mutta sitä ei koskaan toteuteta käytännössä.
Syy tämän prosessin (ja kaikkien maailmankaikkeuden tunnettujen prosessien) peruuttamattomuuteen on järjestelmän siirtyminen todennäköisempään tilaan. Tarkastetussa esimerkissä kahden erilämpöisen kappaleen kosketuksessa todennäköisin tila on se, jossa kaikilla järjestelmän hiukkasilla on sama liike-energia.
Termodynamiikan toinen pääsääntö voidaan muotoilla seuraavasti: "Lämpöä ei voi koskaan siirtyä spontaanisti kylmästä kappaleesta kuumaan." Jos otamme käyttöön entropian käsitteen häiriön mittana, se voidaan esittää seuraavasti: "Kaikki termodynaamiset prosessit etenevät entropian kasvaessa".
Lämpömoottori

Tämä termi ymmärretään järjestelmäksi, joka voi suorittaa mekaanista työtä ulkoisen energian syöttämisen ansiosta. Ensimmäinenlämpökoneet olivat höyrykoneita ja keksittiin 1600-luvun lopulla.
Termodynamiikan toisella pääsäännöllä on ratkaiseva rooli niiden tehokkuuden määrittämisessä. Sadi Carnot totesi myös, että tämän laitteen suurin hyötysuhde on: Tehokkuus=(T2 - T1)/T2, tässä T2 ja T1 ovat lämmittimen ja jääkaapin lämpötiloja. Mekaanista työtä voidaan tehdä vain silloin, kun lämpö virtaa kuumasta kappaleesta kylmään, eikä tätä virtausta voida muuttaa 100-prosenttisesti hyödylliseksi energiaksi.
Alla olevassa kuvassa näkyy lämpömoottorin toimintaperiaate (Qabs - koneeseen siirtynyt lämpö, Qced - lämpöhäviö, W - hyödyllinen työ, P ja V - paine ja kaasun tilavuus männässä).
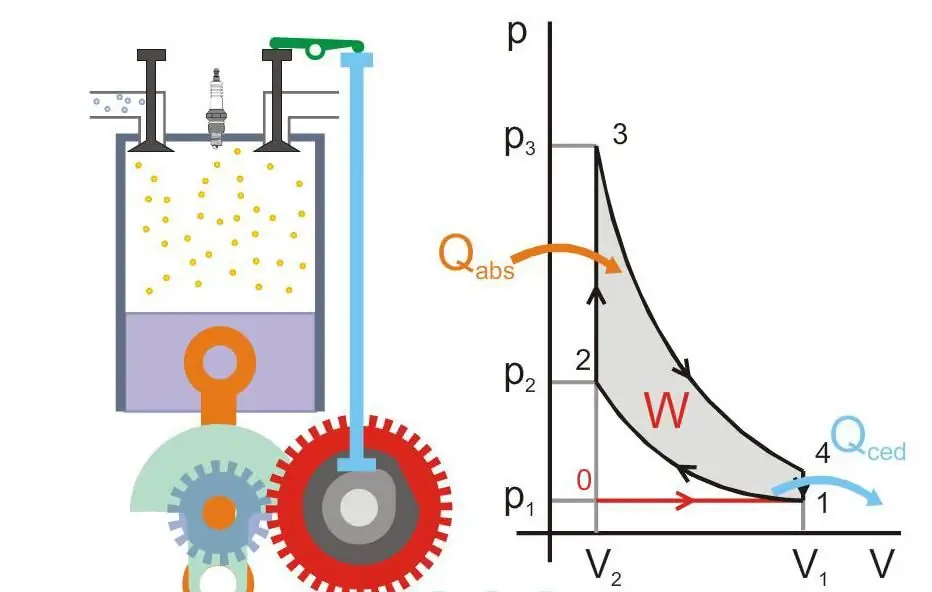
Absoluuttinen nolla ja Nernstin postulaatti
Lopuksi siirrytään termodynamiikan kolmannen pääsäännön tarkasteluun. Sitä kutsutaan myös Nernst-postulaatiksi (saksalaisen fyysikon nimi, joka muotoili sen ensimmäisen kerran 1900-luvun alussa). Laki sanoo: "Absoluuttista nollaa ei voida saavuttaa rajallisella määrällä prosesseja." Eli on mahdotonta millään tavalla "jäädyttää" aineen molekyylejä ja atomeja kokonaan. Syynä tähän on jatkuva lämmönvaihto ympäristön kanssa.

Yksi hyödyllinen johtopäätös termodynamiikan kolmannesta pääsäännöstä on, että entropia pienenee, kun liikkuu kohti absoluuttista nollaa. Tämä tarkoittaa, että järjestelmä pyrkii järjestäytymään. Tämä tosiasia voikäyttää esimerkiksi paramagneettien siirtämiseen ferromagneettiseen tilaan jäähtyessään.
On mielenkiintoista huomata, että alin tähän mennessä saavutettu lämpötila on 5·10−10 K (2003, MIT-laboratorio, USA).






