Adiabaattinen siirtyminen kahden tilan välillä kaasuissa ei kuulu isoprosesseihin, mutta sillä on tärkeä rooli paitsi erilaisissa teknologisissa prosesseissa myös luonnossa. Tässä artikkelissa tarkastelemme, mikä tämä prosessi on, ja annamme myös adiabaattiset yhtälöt ihanteelliselle kaasulle.
Ihanteellinen kaasu lyhyesti
Ihanteellinen kaasu on sellainen, jossa sen hiukkasten välillä ei ole vuorovaikutusta ja niiden koot ovat nolla. Luonnossa ei tietenkään ole olemassa sataprosenttisesti ihanteellisia kaasuja, koska ne kaikki koostuvat molekyyleistä ja kooltaan atomeista, jotka ovat aina vuorovaikutuksessa toistensa kanssa ainakin van der Waalsin voimien avulla. Kuitenkin kuvattu malli suoritetaan usein riittävällä tarkkuudella käytännön ongelmien ratkaisemiseksi monille todellisille kaasuille.
Ideaalikaasun pääyhtälö on Clapeyron-Mendeleevin laki. Se on kirjoitettu seuraavassa muodossa:
PV=nRT.
Tämä yhtälö määrittää tuotteen välisen suoran suhteellisuudenpaine P tilavuuteen V ja aineen määrä n absoluuttiseen lämpötilaan T. R:n arvo on kaasuvakio, jolla on suhteellisuustekijän rooli.
Mikä on adiabaattinen prosessi?
Adiabaattinen prosessi on siirtymä kaasujärjestelmän tilojen välillä, jossa ei tapahdu energian vaihtoa ympäristön kanssa. Tässä tapauksessa järjestelmän kaikki kolme termodynaamista ominaisuutta (P, V, T) muuttuvat ja aineen n määrä pysyy vakiona.
Erottele adiabaattinen laajeneminen ja supistuminen. Molemmat prosessit tapahtuvat vain järjestelmän sisäisen energian ansiosta. Joten laajenemisen seurauksena järjestelmän paine ja erityisesti lämpötila laskevat dramaattisesti. Sitä vastoin adiabaattinen puristus johtaa positiiviseen lämpötilan ja paineen nousuun.
Lämmönvaihdon estämiseksi ympäristön ja järjestelmän välillä jälkimmäisessä on oltava lämpöeristetyt seinät. Lisäksi prosessiajan lyhentäminen vähentää merkittävästi lämmön virtausta järjestelmään ja sieltä pois.
Poisson-yhtälöt adiabaattiselle prosessille

Termodynamiikan ensimmäinen pääsääntö on kirjoitettu seuraavasti:
Q=ΔU + A.
Toisin sanoen järjestelmään välitettyä lämpöä Q käytetään järjestelmän työn A suorittamiseen ja sisäisen energian ΔU lisäämiseen. Adiabaattisen yhtälön kirjoittamiseksi tulee laittaa Q=0, joka vastaa tutkittavan prosessin määritelmää. Saamme:
ΔU=-A.
Isokoorillaprosessissa ihanteellisessa kaasussa, kaikki lämpö menee lisäämään sisäistä energiaa. Tämä tosiasia antaa meille mahdollisuuden kirjoittaa yhtäläisyys:
ΔU=CVΔT.
Missä CV on isokorinen lämpökapasiteetti. Työ A puolestaan lasketaan seuraavasti:
A=PdV.
Missä dV on pieni äänenvoimakkuuden muutos.
Clapeyron-Mendeleev-yhtälön lisäksi ideaalikaasulle pätee seuraava yhtälö:
CP- CV=R.
Missä CP on isobarinen lämpökapasiteetti, joka on aina suurempi kuin isokoorinen, koska se ottaa huomioon paisumisesta johtuvat kaasuhäviöt.
Analysoimalla yllä kirjoitetut yhtälöt ja integroimalla lämpötilan ja tilavuuden suhteen, saamme seuraavan adiabaattisen yhtälön:
TVγ-1=const.
Tässä γ on adiabaattinen indeksi. Se on yhtä suuri kuin isobarisen lämpökapasiteetin suhde isokooriseen. Tätä yhtälöä kutsutaan adiabaattisen prosessin Poisson-yhtälöksi. Clapeyron-Mendeleevin lakia soveltaen voit kirjoittaa kaksi samanlaista lauseketta lisää, vain parametrien P-T ja P-V kautta:
TPγ/(γ-1)=const;
PVγ=const.
Adiabaattinen graafi voidaan antaa eri akseleilla. Alla se näkyy P-V-akseleissa.
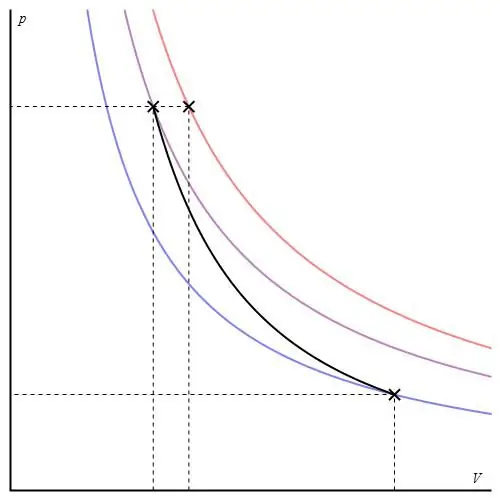
Kävijän värilliset viivat vastaavat isotermejä, musta käyrä on adiabaatti. Kuten voidaan nähdä, adiabaatti käyttäytyy terävämmin kuin mikään isotermeistä. Tämä tosiasia on helppo selittää: isotermille paine muuttuu takaisinverrannollinen tilavuuteen, mutta isobatilla paine muuttuu nopeammin, koska eksponentti on γ>1 mille tahansa kaasujärjestelmälle.
Esimerkkiongelma
Luonnossa, vuoristoisilla alueilla, kun ilmamassa liikkuu rinnettä ylöspäin, sen paine laskee, sen tilavuus kasvaa ja jäähtyy. Tämä adiabaattinen prosessi alentaa kastepistettä ja tuottaa nestemäistä ja kiinteää saostumaa.

Seuraavan ongelman ratkaisemiseksi ehdotetaan: nostettaessa ilmamassaa vuoren rinnettä pitkin paine putosi 30 % jalan paineeseen verrattuna. Mikä oli sen lämpötila, jos se jalassa oli 25 oC?
Ratkaise ongelma käyttämällä seuraavaa adiabaattista yhtälöä:
TPγ/(γ-1)=const.
On parempi kirjoittaa se tässä muodossa:
T2/T1=(P2/P 1)(γ-1)/γ.
Jos P1 otetaan 1 atmosfäärinä, niin P2 on yhtä suuri kuin 0,7 ilmakehää. Ilman adiabaattinen indeksi on 1,4, koska sitä voidaan pitää kaksiatomisena ideaalikaasuna. T1 lämpötila-arvo on 298,15 K. Korvaamalla kaikki nämä luvut yllä olevaan lausekkeeseen, saadaan T2=269,26 K, mikä vastaa - 3, 9 oC.






